Ciepło – definicja
Ciepło to jedna z form przekazywania energii pomiędzy układem a otoczeniem na skutek istniejącej pomiędzy nimi różnicy temperatury. Ze zjawiskiem transferu (przepływu) ciepła spotykamy się praktycznie codziennie. Jednym z takich przykładów jest proces przekazywania energii termicznej (energii cieplnej) pomiędzy gorącym kubkiem, tj. układem, a otoczeniem, czyli miejscem, w którym znajduje się kubek (np. pokój). Konsekwencją tego przekazu energii jest proces stopniowego zmniejszania się temperatury kubka, zachodzący aż do chwili, w której temperatura kubka zrówna się z temperaturą otoczenia – innymi słowy proces ten trwa do momentu osiągnięcia przez kubek oraz otoczenie stanu równowagi termodynamicznej.
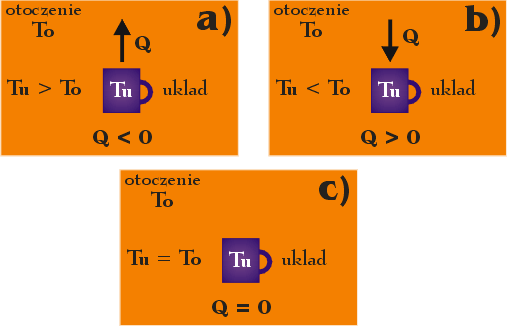
Przepływ ciepła pomiędzy układem a otoczeniem
Energia termiczna, o której wcześniej wspomnieliśmy, to energia wewnętrzna związana z energią potencjalną i kinetyczną obiektów (atomów, cząsteczek) tworzących dany obiekt (układ). W opisanym powyżej przykładzie układ, czyli kubek, posiada wyższą temperaturę Tu w porównaniu z temperaturą otoczenia To , w związku z czym kubek przekazuje część ze swojej energii termicznej do otoczenia i dlatego mówimy, że układ oddaje ciepło. W takiej sytuacji przyjmujemy, że ciepło, oznaczane dużą literą Q, jest ujemne (Q < 0). W przypadku, gdy temperatura układu jest niższa od temperatury otoczenia, transfer energii odbywa się pomiędzy otoczeniem a układem – mówimy wówczas, że układ pobiera ciepło. W takiej sytuacji przyjmujemy, że ciepło jest dodatnie (Q > 0). W przypadku, gdy Tu = To ciepło nie jest przekazywane, a więc Q = 0.
Ciepło – jednostka
Jednostką ciepła w układzie SI jest jednostka energii, czyli dżul (ozn. J). Wcześniej tj. zanim zrozumiano, że ciepło jest jedną z form przekazywania energii pomiędzy układem a otoczeniem, jednostką ciepła była kaloria, oznaczana jako cal. Jedna kaloria definiowana była jako ilość ciepła powodująca zwiększenie temperatury jednego grama wody z 14,5 oC na 15,5 oC. Obecnie kalorię definiuje się w oparciu o obecną jednostkę ciepła, pomiędzy którymi zachodzi następująca relacja:
$$1 \hspace{.1cm} \rm{cal} = 4,\hspace{-.1cm}1860 \hspace{.1cm} \rm{J}$$
Wielokrotność kalorii tj. kilokalorię (tysiąc kalorii), oznaczaną jako kcal, powszechnie stosuje się w wyrażaniu wartości energetycznej produktów żywnościowych.

Dodaj komentarz